Defektes Enzym als Auslöser für Nervenverlust bei Demenz identifiziert
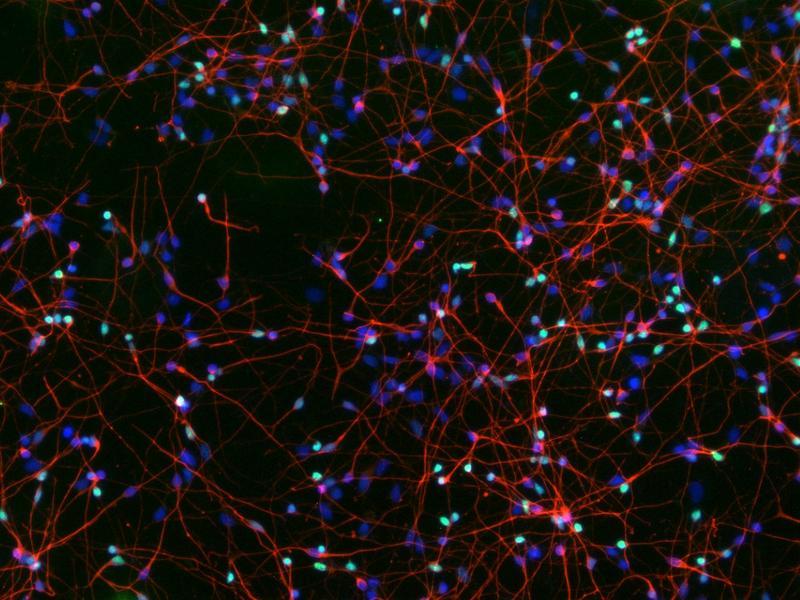
Das Enzym, das Nervenzellen schützt
Warum sterben Nervenzellen bei Demenz – und lässt sich dieser Prozess bremsen? Ein internationales Team um Prof. Marcus Conrad, Direktor des Instituts für Metabolismus und Zelltod bei Helmholtz Munich und Professor für Translationale Redoxbiologie an der Technischen Universität München (TUM), beschreibt im Fachjournal Cell, wie sich Nervenzellen gegen das Zelltodprogramm „Ferroptose“ schützen.
Zentral für diesen Schutzmechanismus ist das Selenoenzym Glutathionperoxidase 4 (GPX4). Eine einzelne Mutation in dem Gen, das für das Enzym GPX4 codiert, kann einen entscheidenden bis dato unbekannten Bestandteil der Enzymfunktion zerstören. Das führt bei betroffenen Kindern zu einer schweren frühkindlichen Demenz. Ist es voll funktionsfähig, taucht GPX4 mit einer Proteinschlaufe, einer Art „Finne“, von innen in die Zellmembran der Nervenzellen ein. Dort macht es schädliche Substanzen, die Lipidperoxide, unschädlich.
Surfen auf der Zellmembran
„Man kann sich GPX4 wie ein Art Surfbrett vorstellen“, sagt Conrad: „Mit der Finne in die Zellmembran eingetaucht, surft es auf dieser herum – und beseitigt schädliche Lipidperoxide.“ Eine bei Kindern mit frühkindlicher Demenz gefundene Punktmutation verändert jedoch die flossenartige Proteinschlaufe von GPX4: Das Enzym taucht nicht mehr so effizient in die Zellmembran ein, dass es seine Schutzfunktion erfüllen kann. Die Lipidperoxide schädigen nun die Membran, was letztlich die Ferroptose auslöst. Die Nervenzellen sterben ab.
Ausgangspunkt der Studie waren drei Kinder in den USA, die an einer extrem seltenen Form frühkindlicher Demenz leiden. Bei allen dreien liegt dieselbe genetische Veränderung im GPX4-Gen vor („R152H“). Dank der Zellproben eines betroffenen Kindes konnten die Forschenden die Auswirkungen der Mutation näher studieren und setzten die Zellen in einen stammzellartigen Zustand zurück. Aus diesen reprogrammierten Stammzellen wiederum züchteten sie Nervenzellen der Großhirnrinde sowie dreidimensionale Gewebestrukturen, die frühem Hirngewebe ähneln: sogenannte Hirnorganoide.
Auch im Labor zeigt sich: Ohne funktionsfähiges GPX4 entwickelt sich Demenz
Um zu verstehen, was im gesamten Organismus passiert, übertrug das Team die R152H-Mutation anschließend auf ein Mausmodell und veränderte so gezielt das Enzym GPX4 in unterschiedlichen Nervenzellen. Durch die veränderte GPX4-Funktion traten nach und nach Bewegungsstörungen auf, Nervenzellen gingen im Groß- und im Kleinhirn verloren und es entwickelten sich starke Entzündungsreaktionen – ein Bild, das gut zu den Beobachtungen bei den betroffenen Kindern passt und stark an neurodegenerative Krankheitsbilder erinnert.
Parallel dazu untersuchten die Forschenden im experimentellen Modell, welche Proteine im Gehirn in ihrer Menge verändert waren. Dabei zeigte sich ein Muster, das auffallend dem bei Patient:innen mit Alzheimer-Demenz ähnelt: Zahlreiche Proteine, die bei Alzheimer erhöht oder vermindert sind, waren auch im Mausmodell ohne funktionsfähiges GPX4 fehlreguliert. Das deutet darauf hin, dass ferroptotischer Stress nicht nur bei dieser seltenen frühkindlichen Erkrankung, sondern möglicherweise auch bei vielfach häufigeren Formen von Demenz eine wichtige Rolle spielt.
Ein neuer Blick auf die Ursachen von Demenz
„Unsere Daten sprechen dafür, dass Ferroptose eine treibende Kraft hinter dem Sterben von Nervenzellen sein kann – nicht nur ein Nebeneffekt“, sagt Dr. Svenja Lorenz, eine der Erstautoren der Studie. „Bisher lag der Fokus bei Demenzerkrankungen oft auf Eiweißablagerungen, die sogenannten Amyloid ß Plaques, im Gehirn. Wir rücken nun stärker die Schädigungen an den Zellmembranen in den Blick, die diesen Zerfall überhaupt erst auslösen.“
Erste Experimente zeigen zudem, dass sich der durch GPX4-Verlust ausgelöste Zelltod in Zellkulturen und im Mausmodell mit Wirkstoffen bremsen lässt, die speziell die Ferroptose hemmen. „Das ist ein wichtiger Machbarkeitsnachweis, aber noch keine Therapie“, betont Dr. Tobias Seibt, Nephrologe im Transplantationszentrum am LMU Klinikum und Co-Erstautor. Dr. Adam Wahida, ebenfalls Erstautor der Studie, ergänzt: „Langfristig könnten wir uns genetische oder molekulare Strategien vorstellen, die dieses Schutzsystem stabilisieren. Bis dahin bleibt unsere Arbeit klar im Bereich der Grundlagenforschung.“
Grundlagenforschung hilft, Krankheiten ursächlich zu verstehen
Die Studie ist das Ergebnis eines über viele Jahre gewachsenen Verbunds aus Genetik, Strukturbiologie, Stammzellforschung und Neurowissenschaften – mit mehreren Dutzend Forschenden an verschiedenen Standorten weltweit. „Wir haben fast 14 Jahre gebraucht, um einen kleinen bislang unbekannten strukturellen Baustein eines Enzyms mit einer schweren Erkrankung zu verknüpfen“, sagt Marcus Conrad. „Solche Projekte zeigen eindrücklich, warum wir langfristig finanzierte Grundlagenforschung und internationale, multidisziplinäre Teams brauchen, um komplexe Krankheiten wie Demenz wirklich zu verstehen.“
Original-Publikation
A fin-loop-like structure in GPX4 underlies neuroprotection from ferroptosis.
Lorenz et al.
Cell (2026)
DOI: https://doi.org/10.1016/j.cell.2025.11.014
Über die Wissenschaftler und Wissenschaftlerinnen
Prof. Marcus Conrad ist Direktor des Instituts für Metabolismus und Zelltod bei Helmholtz Munich und Professor für Translationale Redoxbiologie an der Technischen Universität München (TUM).
Dr. Adam Wahida ist Post-Doktorand am Institut für Metabolismus und Zelltod bei Helmholtz Munich.
Dr. Svenja Lorenz ist Post-Doktorandin am Institut für Metabolismus und Zelltod bei Helmholtz Munich.
Dr. Tobias Seibt ist Facharzt für Innere Medizin und Nephrologie am LMU Klinikum München.
Kontakt
Dr. Tobias Seibt
Facharzt für Innere Medizin und Nephrologie Transplantationszentrum München LMU Klinikum München.

