PRIDE

PRotektive VEGF-Inhibition zur
Isotoxischen DosisEskalation beim
Glioblastom
Das Glioblastom ist der häufigste und aggressivste hirneigene Tumor. Trotz intensiver Therapie mit Resektion, postoperativer Radiochemotherapie und anschließender sequentieller Erhaltungstherapie entsteht häufig ein Lokalrezidiv, was unter anderem weiterhin die infauste Prognose bedingt. Standardmäßig wird die Radiotherapie bis zu einer Gesamtdosis von 60 Gy mit 2 Gy pro Fraktion eingesetzt. Es gibt jedoch Hinweise, dass diese Dosierung für eine suffiziente Tumorkontrolle nicht ausreicht. Eine Dosiseskalation konnte zwar in einzelnen Studien zu einer höheren lokalen Kontrolle führen, brachte jedoch auch eine signifikant höhere Nebenwirkungsrate mit.
Im Rahmen der PRIDE Studie soll eine Dosiseskalation durchgeführt werden, dabei wird jedoch konkomitant zur Radiochemotherapie zweimalig der VEGF (vascular endothelial growth factor) Inhibitor Bevacizumab verabreicht, um den erhöhten Nebenwirkungen der Eskalation entgegenzuwirken. Dadurch erwarten wir bei der dosiseskalierten Radiochemotherapie ein vergleichbares Nebenwirkungsprofil wie bei der Standardtherapie mit 60 Gy. Ziel der Studie ist es, ein verbessertes Gesamtüberleben zu erreichen, ohne dass die Nebenwirkungsrate signifikant ansteigt.
Was soll untersucht werden
Es handelt sich um eine nicht-randomisierte, multizentrische Phase-IIa-Studie zur Radiochemotherapie mit isotoxischer Dosiseskalation und protektiver VEGF-Hemmung mit Bevacizumab bei der Behandlung von Patienten mit der Erstdiagnose eines Glioblastoms vom IDH-Wildtyp und nicht methyliertem MGMT. Der primäre Endpunkt der Studie ist das Gesamtüberleben.
Wer führt die Studie durch?
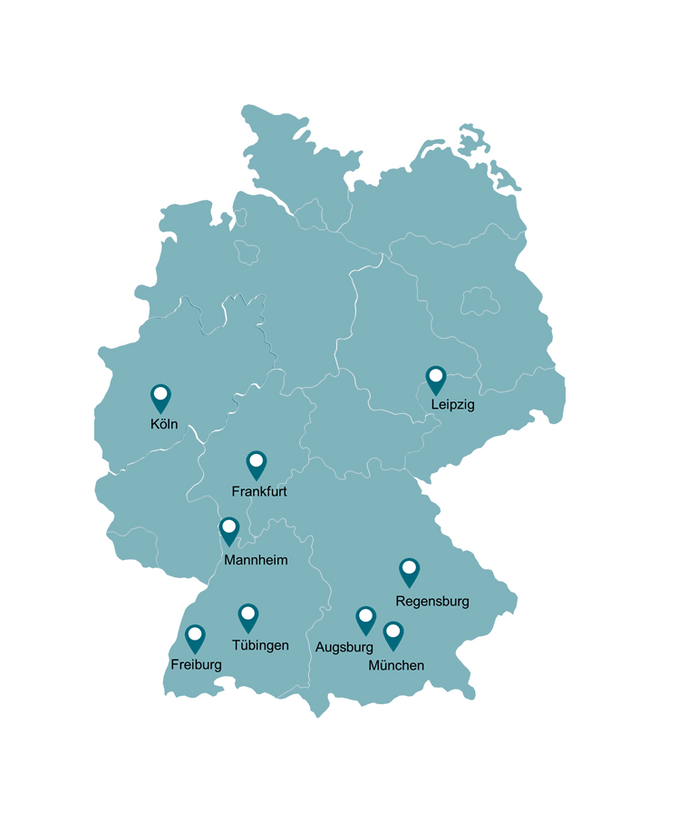
Neben dem LMU Klinikum in München nehmen acht weitere Unikliniken in ganz Deutschland an der Studie teil. Die Bestrahlung sowie die Visiten werden durch das jeweilige Zentrum an den teilnehmenden Kliniken durchgeführt.
Wie sieht der Ablauf der Studie aus?
Die Radiochemotherapie dauert insgesamt 6 Wochen (30 Werktage), also nicht länger als die Standardtherapie, da der Boost simultan integriert verabreicht wird. Währenddessen wird Bevacizumab zweimal (im Abstand von drei Wochen) appliziert. Etwa 6 Wochen nach der Radiochemotherapie wird die Erhaltungstherapie mit 6 Zyklen Temozolomid 150-200 mg/m2 initiiert. Alle Patientinnen und Patienten werden zum ersten Mal 4-6 Wochen nach Radiochemotherapie und anschließend alle 3 Monate mittels klinischer Untersuchung und MRT des Schädels nachgesorgt.


Wer kann teilnehmen?
Teilnehmen können alle Patientinnen und Patienten mit neu diagnostiziertem Glioblastom.
- Alter 18 bis 70 Jahre
- ECOG 0, 1 oder 2
- IDHwt, MGMT nicht methyliert
- Adäquate Kontrazeption
- Bereitschaft, an den vorgesehenen Visiten im Rahmen der Studie teilzunehmen
Wer kann nicht teilnehmen?
- Kürzlicher Nachweis einer nicht-operationsbedingten kranialen Hämorrhagie
- Einnahme eines Medikaments das zu einer Wechselwirkung mit Bevacizumab führen könnte
- Patienten mit Immundefizienz, inklusive HIV-Positivität
- Unverträglichkeit mit einer Komponente des Studienmedikaments (Allergie oder andere Unverträglichkeit gegenüber Bevacizumab oder anderen Zusätzen)
- Weitere signifikante Nebendiagnosen oder signifikante laborchemische Befunde
- Kontraindikation für ein cMRT
- Vorherige Behandlung mit Bevacizumab
Interesse an einer Teilnahme?
Schreiben Sie uns gerne eine E-Mail an:
Strahl.Pride-Studie@med.uni-muenchen.de
oder melden Sie sich telefonisch bei einem der angegebenen Standorte.
- Universitätsklinikum Augsburg
- Universitätsklinikum Frankfurt am Main
- Universitätsklinikum Freiburg
- Universitätsklinikum Köln
- Universitätsklinikum Leipzig
- Universitätsklinikum Mannheim
- Universitätsklinikum Regensburg
- Universitätsklinikum Tübingen
Finanzierung der Studie




