Aktuelles aus der Forschung

Virtuelle Patientenmodelle weisen auf Zellkern-zerstörendes Medikament als neue Therapie gegen kindlichen Leberkrebs hin
Neuer Hoffnungsträger bei Hepatoblastomen
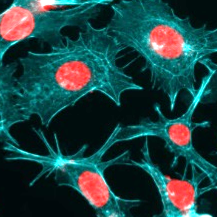
Ein bereits zugelassenes Krebsmedikament könnte dank virtueller Patientenmodelle auch aggressiven Lebertumoren bei Kindern wirksam begegnen. Forschende aus der kinderchirurgischen Klinik zeigen, wie Ceritinib Tumorzellen von innen heraus schwächt.
München, September 2025
Ein Forschungsteam um Herrn Professor Roland Kappler hat entdeckt, dass Ceritinib, ein bereits für bestimmte Formen von Lungenkrebs zugelassenes Medikament, auch zur Behandlung aggressiver kindlicher Lebertumoren eingesetzt werden könnte. Der Durchbruch gelang mithilfe sogenannter „digitaler Zwillinge“, die auf den klinischen und genetischen Daten junger Patientinnen und Patienten basieren. Mit diesen virtuellen Patienten kann vorab simuliert werden, wie verschiedene Medikamente wirken könnten, noch bevor sie ins Labor gehen. In den Simulationen schnitt Ceritinib als besonders vielversprechend ab. Labortests an Zellkulturen und Untersuchungen an Mäusen mit Patienten-abgeleiteten Tumoren bestätigten die Vorhersage: Ceritinib verlangsamte das Tumorwachstum, schädigte gezielt die Zellkerne der Krebszellen und leitete deren Absterben ein. „Das Spannende ist, dass Ceritinib auf völlig unerwartete Weise wirkt - indem es die Struktur zerstört, die den Zellkern der Krebszellen schützt“, erklärt Dr. Salih Demir, der die experimentellen Arbeiten durchführte. „Dadurch wird der Tumor von innen geschwächt und angreifbar.“ Für Kinder mit Hochrisiko-Lebertumoren gibt es bislang nur sehr begrenzte Behandlungsmöglichkeiten, und die Überlebenschancen sind oft gering. Die Studie zeigt, wie virtuelle Patientenmodelle die Entwicklung neuer Therapien beschleunigen können und Hoffnung auf schnelleren Zugang zu lebensrettenden Behandlungen geben.
Großzügige Spende für onkologische Forschung
Gutes tun und sinnvoll helfen

Diesem Motto hat sich der Verein Gänseblümchen-Voerde verschrieben. Der ehrenamtlich tätige Verein unterstützt auch in diesem Jahr die onkologische Forschung an der Kinderchirurgischen Klinik mit 20.000 Euro.
München, Juli 2025
Der ehrenamtlich tätige Verein Gänseblümchen-Voerde unterstützt seit seiner Gründung im Jahre 2007 den Alltag auf onkologischen Kinderstationen durch materielle Anschaffungen, Kostenübernahmen von Hilfsmitteln und fachspezifische Angebote wie pädagogisches Reiten, Bastelstunden und Erholungsfahrten. Darüber hinaus finanziert der Verein auch Forschungsinitiativen, die sich mit der Verbesserung von Diagnose- und Therapiemöglichkeiten bei Kindern mit Krebserkrankungen beschäftigen. Im Juli dieses Jahres überreichte der Vorsitzende des Vereins Herr Tobias Modrzejewski einen Scheck in Höhe von 20.000 Euro an Herrn Professor Roland Kappler für die onkologische Forschung an der Kinderchirurgischen Klinik. „Das Geld wollen wir für die Erforschung von sogenannten Biomarkern einsetzen, also messbaren biologischen Eigenschaften, die es erlauben, eine Abschätzung des Gefährdungspotentials von Tumorpatienten vorzunehmen“, so Kappler. Eine besonders geeignete biologische Messgröße stellt dabei die in Tumoren häufig nachzuweisende gesteigerte Aktivität von Genen dar, die mit einer metastasierten Erkrankung assoziiert sind. Die Untersuchung solcher Veränderungen würde eine ganz neue Herangehensweise auf dem Weg hin zu einer individuellen Therapie ermöglichen, die auf dem persönlichen molekularen Profil der Patienten basiert. Zusammen mit Frau Professor Irene Schmid, Leiterin der nationalen Studiengruppe für Lebertumoren bei Kindern, sollen in den nächsten Jahren anhand eines großen Patientenkollektivs verschiedene Biomarker auf deren klinische Relevanz überprüft werden.

Weitere Informationen
Kontinuierliche Forschungsförderung
Bettina-Bräu-Stiftung finanziert Doktorandenstelle

München, März 2025
Unter dem Motto „Mehr LEBEN für krebskranke Kinder“ unterstützt die selbstlos tätige Bettina Bräu Stiftung seit vielen Jahren die Arbeit mit krebskranken Kindern, in der Hoffnung, dass eines Tages „kein Kind mehr den Kampf gegen diese Krankheit verlieren muss“, so die Mitbegründerin Frau Irmgard Bräu. Neben der finanziellen Unterstützung sozialer Projekte und der Förderung verbesserter medizinischer Maßnahmen und Heilmethoden widmet sich die Stiftung auch intensiv der Ursachenforschung kindlicher Krebserkrankungen. Ein besonderer Schwerpunkt liegt dabei auf der Förderung wissenschaftlicher Arbeiten, die langfristig zu besseren Heilungschancen beitragen sollen. Seit mehr als 15 Jahren ist die Bettina Bräu Stiftung ein verlässlicher Partner für die kinderchirurgische Forschung. Durch ihre diesjährige Unterstützung konnte erneut eine Doktorandenstelle zur Erforschung von Lebertumorerkrankungen im Kindesalter eingerichtet werden. Im Rahmen des Doktoranden-Projektes „Biomarker und Therapie des Hepatoblastoms“ werden zwei Hauptziele verfolgt: Zum einen sollen bestimmte Merkmale in den Tumoren, sogenannte Biomarker, identifiziert werden, die eine individuellere und risikoangepasste Behandlung ermöglichen. Zum anderen werden neue Medikamente entwickelt und getestet, um die Therapie künftig noch wirksamer und zugleich schonender zu gestalten. „Unsere Ergebnisse werden es ermöglichen, diese Biomarker bereits in einem frühen Stadium der Erkrankung zu testen und damit zusätzliche Therapieoptionen zu eröffnen“, erklärt Professor Roland Kappler, Leiter des Forschungsprojekts.
Bahnbrechende Therapie gibt jungen Krebspatienten Hoffnung
Histon-Deacetylase-Hemmer gegen metastasierte Hepatoblastome

Revolutionäre Behandlungsstrategie kombiniert etablierte Chemotherapie mit zielgerichtetem Medikament, um die Beseitigung von Lungenmetastasen zu verbessern.
München, November 2024
Die Klinik für Kinderchirurgie, ein führendes Zentrum für innovative Gesundheitslösungen, freut sich, eine wegweisende Neuerung in der Behandlung des metastasierten Hepatoblastoms vorzustellen - einer seltenen, jedoch aggressiven Form von Leberkrebs bei Kindern. Mithilfe modernster präklinischer Forschung wurde ein neuer Therapieansatz entwickelt, der vielversprechende Verbesserungen für Patienten bietet, deren Krankheitsverlauf durch Lungenmetastasen kompliziert wird. „Patienten mit metastasiertem Hepatoblastom sind derzeit auf stark belastende Erstlinien-Chemotherapien in Kombination mit operativen Eingriffen angewiesen. Doch die oft unzureichende Wirkung dieser Therapien auf Lungenmetastasen stellt eine erhebliche Herausforderung für den Behandlungserfolg dar“, so Herr Professor Roland Kappler, Leiter der Studie. Um diesem dringenden medizinischen Bedarf gerecht zu werden, hat seine Forschungsgruppe eine innovative Behandlungsstrategie entwickelt und validiert, die gezielt auf eine effektivere Eliminierung von Lungenmetastasen ausgerichtet ist. „Mit einer von uns neu etablierten Testplattform, basierend auf Patienten-abgeleiteten Tumormodellen, sowie einer Reihe von in-vitro- und in-vivo-Tests, konnten wir gezielt das vielversprechendste Medikament für das metastasierte Hepatoblastom identifizieren“, erklärt Dr. Salih Demir, der die experimentellen Arbeiten leitete. Diese Forschung führte zur Entdeckung des Histon-Deacetylase-Inhibitors Panobinostat, der in Kombination mit dem aktuellen SIOPEL-4-Chemotherapieprotokoll bereits in niedrigen Dosierungen eine außergewöhnliche Wirksamkeit zeigte. Besonders in dreidimensionalen Modellen von Lungenmetastasen führte die Behandlung mit Panobinostat zu einer vollständigen und selektiven Eliminierung der Tumorzellen. Die Simulation einer klinischen Studie unter Laborbedingungen bestätigte das enorme Potenzial dieses therapeutischen Ansatzes. „Unsere Ergebnisse markieren einen bedeutenden Fortschritt in der pädiatrischen Onkologie und geben jungen Krebspatienten und ihren Familien neue Hoffnung“, betont Professor Kappler. Eine europaweite klinische Therapieoptimierungsstudie befindet sich derzeit in Vorbereitung. Dieses wegweisende Projekt unterstreicht das Engagement der Klinik für Kinderchirurgie, innovative und wirkungsvolle Lösungen für schwer behandelbare Erkrankungen zu entwickeln und die Lebensqualität betroffener Kinder nachhaltig zu verbessern.
Vagabond
Europäisches Ausbildungsprogramm stärkt wissenschaftlichen Nachwuchs

Utrecht/München, September 2024
Auch die Kinderchirurgische Klinik des Dr. von Haunerschen Kinderspitals war unter Leitung von Professor Roland Kappler aktiv an dem europaweiten Ausbildungsverbund beteiligt. Das dort angesiedelte Projekt widmete sich den Mutationen im ATRX-Gen beim Hepatoblastom – einem seltenen, aber aggressiven Lebertumor im Kindesalter – und der Entwicklung neuer, zielgerichteter Behandlungsstrategien. Die Forschungsergebnisse sollen langfristig dazu beitragen, personalisierte Therapien für betroffene Kinder zu ermöglichen. Die am Dr. von Haunerschen Kinderspital geförderte Doktorandin Frau Negin Razizadeh zeigt sich begeistert von den Chancen, die ihr das Programm eröffnet hat: „Das Marie-Skłodowska-Curie-Programm hat mir eine einzigartige Möglichkeit geboten, als Teil einer neuen Generation international vernetzter Forscher ausgebildet zu werden. Ich konnte auf die Ressourcen und Expertise renommierter Universitäten sowie innovativer Unternehmen in Europa zurückgreifen. Durch die Arbeit in führenden Forschungslabors fühle ich mich bestens vorbereitet, zukünftige Herausforderungen in der Entwicklung individualisierter Therapien in der Pädiatrischen Onkologie erfolgreich zu meistern.“ Mit Abschluss des vierjährigen Programms zieht das Konsortium auf seiner Abschlussveranstaltung am Prinzessin Maxima Zentrum in Utrecht eine positive Bilanz: Die intensive Zusammenarbeit über Länder- und Fachgrenzen hinweg hat nicht nur einzigartige Ausbildungswege ermöglicht, sondern auch entscheidende Impulse für die Kinderkrebsforschung in Europa gesetzt.
iPC
Projektabschluss des internationalen Forschungsverbunds

München, Februar 2024
Unter der wissenschaftlichen Leitung von IBM und der Koordination durch TECHNIKON haben sich 21 Partner aus elf Ländern – darunter auch die USA und Australien – zusammengeschlossen, um in den vergangenen vier Jahren ein zukunftsweisendes Ziel zu verfolgen: Aus genomischen Sequenzierungsdaten und klinischen Patientendaten mittels computergestützter Lernmodelle potenzielle Therapieansätze für Krebserkrankungen im Kindesalter zu entwickeln. Im Rahmen des EU-geförderten Projekts iPC wurden modernste Technologien wie Supercomputing, maschinelles Lernen und mechanistische Modellierung eingesetzt, um Ärztinnen und Ärzten neue Werkzeuge für die personalisierte Therapieplanung zur Verfügung zu stellen. Mittels digitaler Zwillinge – virtueller Patientenmodelle – können Behandlungsstrategien bereits im Computer auf Wirksamkeit und mögliche Nebenwirkungen getestet werden. Dieser Ansatz soll langfristig dazu beitragen, die Überlebenschancen junger Patientinnen und Patienten zu verbessern und ihre Lebensqualität deutlich zu steigern.
Die Kinderchirurgische Klinik des Dr. von Haunerschen Kinderspitals war mit einem Forschungsprojekt zu Lebertumoren im Kindesalter im Konsortium vertreten. Projektleiter Professor Roland Kappler betont die Bedeutung der entwickelten Technologien: „Die groß angelegte in-silico-Erprobung unterschiedlichster Behandlungsmodelle wird Kliniker künftig in die Lage versetzen, innerhalb einer cloudbasierten Anwendung spezifische Therapieoptionen und -kombinationen für jeden einzelnen Patienten abzurufen.“ Während die Komplexität kindlicher Krebserkrankungen die wissenschaftliche Gemeinschaft weiterhin vor immense Herausforderungen stellt, zeigt der erfolgreiche Abschluss von iPC, wie europäische Forschungsinitiativen durch den Einsatz hochmoderner Technologien und die enge Zusammenarbeit internationaler Expertinnen und Experten konkrete Fortschritte für eine bessere Versorgung und Behandlung krebskranker Kinder ermöglichen. „Die drei im Rahmen des Projekts aus unserem Haus veröffentlichten Studien zur potenziellen Anwendung von Dinaciclib, Panobinostat und Ceritinib in klinischen Prüfungen zeigen eindrucksvoll das große Potenzial dieses Ansatzes“, schließt Professor Kappler.
Forschungsprojekt der Kinderchirurgie erhält Förderung durch die European Science Foundation
BT4ChildLC

Unter diesem Akronym läuft in den nächsten drei Jahren ein Forschungsprojekt zur Identifizierung prädiktiver Biomarker und neuartiger biologisch orientierter Therapien für Leberkrebspatienten im Kindesalter.
München, April 2023
„Wir sind überaus glücklich, dass unsere langjährigen Forschungsanstrengungen im Rahmen der internationalen Therapieoptimierungsstudie PHITT nun durch eine Förderung im Fight Kids Cancer Programm der European Science Foundation belohnt werden“, so Herr Professor Roland Kappler aus der Kinderchirurgischen Klinik, der von deutscher Seite aus an diesem Forschungsverbund beteiligt ist. Das Projekt hat eine Laufzeit von drei Jahren und bündelt die Expertise von fünf Forschungsgruppen aus München, Utrecht, Barcelona, Nottingham und Padua, die sich der Erforschung kindlicher Lebertumoren verschrieben haben. Innerhalb dieses Forschungsverbundes soll zunächst ein neuartiges Risikostratifizierungssystem für Hepatoblastompatienten definiert werden, das sowohl klinische als auch molekulare Merkmale kombiniert, und mit dem zukünftig eine verbesserte Abschätzung der Prognose ermöglicht werden soll. Ein weiteres Ziel ist die Identifizierung neuer therapeutischer Ansätze, die durch die bioinformatische Analyse genomweiter Datensätze über Genmutationen und Genaktivitäten erarbeitet werden sollen. Das Team um Herrn Professor Roland Kappler stellt dabei seine Medikamenten-Testplattform zur Verfügung, auf der in Hochdurchsatzverfahren neue Therapieansätze an einem repräsentativen Kollektiv Patienten-abgeleiteter Zellkulturen untersucht werden können. „Letztendlich wollen wir den Weg für eine biologisch orientierte Präzisionsmedizin bei pädiatrischen Lebertumoren ebnen, indem wir prädiktive Biomarker und wirksame Medikamente anbieten, um aktuelle Therapiestrategien zu verbessern und so das Überleben und die Lebensqualität dieser Kinder positiv zu beeinflussen“, erläutert Professor Roland Kappler.
Neuer Therapieansatz zur Behandlung von kindlichen Lebertumoren
Translationale Forschung

Das Team um Professor Roland Kappler veröffentlicht präklinische Studie über den Einsatz eines Medikaments gegen Wurmbefall zur Therapie Chemotherapie-resistenter Lebertumoren.
München, August 2022
Hepatoblastom-Patienten, deren Tumoren nicht auf eine präoperative Chemotherapie ansprechen und deshalb häufig nicht erfolgreich operiert werden können, haben oftmals eine schlechte Prognose. Die Entwicklung neuer Wirkstoffe und therapeutischer Optionen für diese Patienten ist daher von größter Bedeutung. „Die Umnutzung von Medikamenten mit bekannten Wirk- und Sicherheitsprofilen, die zuvor für andere Erkrankungen zugelassen wurden, ist eine vielversprechende Strategie, um die Kosten und den Zeitaufwand für die Entwicklung neuer Krebsmedikamente zu reduzieren“, so Professor Roland Kappler, Leiter dieser Forschungsarbeit. Sein Team konnte aus der vergleichenden Analyse von Genexpressionsdaten Chemotherapie-resistenter und auf Chemotherapie ansprechender Tumoren mithilfe einer speziellen Software zur Medikamentenvorhersage einen Wirkstoff identifizierten, der normalerweise zur Behandlung bei parasitärem Wurmbefall eingesetzt wird. Frau Qian Li, Erstautorin dieser wissenschaftlichen Veröffentlichung, führt aus, dass „wir in verschiedenen Zellkulturmodellen des Hepatoblastoms nicht nur die Wirksamkeit dieses Medikaments namens Mebendazol nachweisen, sondern auch die zellulären und molekularen Folgen der Behandlung identifizieren konnten.“ So führt die Gabe von Mebendazol zur Hemmung der Tumorzellteilung und der Aktivierung des programmierten Zelltods durch die Herabregulierung von Genen, die am sogenannten „Unwindosom“ beteiligt sind. Dieser Proteinkomplex ist für das Entwinden der doppelsträngigen DNA während ihrer Vervielfältigung verantwortlich. Interessanterweise war die Aktivität der entsprechenden Gene bei Tumoren, die nicht auf eine Chemotherapie ansprachen, oder bei Patienten mit geringerer Überlebenswahrscheinlichkeit, stark erhöht. Ein wichtiger Schritt in Richtung klinischem Einsatz von Mebendazol bei Hepatoblastom-Patienten stellt der Nachweis der Wirksamkeit des Medikaments in von Patienten abgeleiteten Xenograft-Modellen dar, bei gleichzeitig geringem Nebenwirkungsprofil. „Zusammenfassend beschreiben unsere Ergebnisse die erfolgreiche Umnutzung von Mebendazol als neue Behandlungsoption für Chemotherapie-resistente Hepatoblastome“, schließt Professor Roland Kappler.

